Polarità del legame covalente
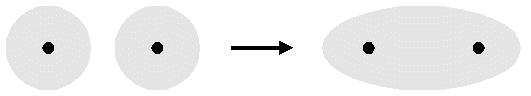
Un legame covalente si definisce puro o omopolare quando la differenza di elettronegatività tra i due atomi è minima. In questo caso si assiste ad una condivisione equa del doppietto elettronico, quindi la nuvola dell’orbitale molecolare è simmetrica e non si ha separazione di carica. Atomi dello stesso elemento, come per esempio accade per $F_2$ o $H_2$, instaurano un legame covalente omopolare.
Il legame covalente polare o eteropolare si forma tra atomi diversi aventi differenza di elettronegatività generalmente compresa tra 0,4 e 1,7. La condivisione del doppietto elettronico non è equa e la nube elettronica, pur appartenendo ad entrambi gli atomi, tende ad addensarsi verso l’elemento più elettronegativo. L’atomo meno elettronegativo assume così una frazione di carica positiva mentre l’atomo più elettronegativo assume una frazione di carica negativa. Queste cariche presenti all’estremità del legame sono chiamate cariche parziali. Un esempio di legame covalente polare è dato dall’acido cloridrico HCl.
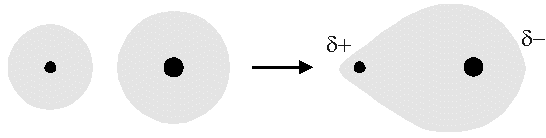
Il trasferimento del doppietto elettronico condiviso dipende dall’entità della differenza di elettronegatività; maggiore è la differenza di elettronegatività e più netto sarà il trasferimento di carica e più marcate sono le cariche che si localizzano sugli atomi.
Legame covalente dativo o di coordinazione
Il legame covalente si forma tra due atomi che condividono un doppietto elettronico; ciascuno dei due atomi mette a disposizione un elettrone. Il legame dativo è un tipo particolare di legame covalente in quanto uno dei due atomi, definito donatore, fornisce la coppia di elettroni e la condivide con un altro atomo detto accettore.
L’atomo donatore deve disporre di un doppietto solitario (o doppietto non condiviso o coppia di non legame) che per definizione è un doppietto elettronico non impegnato in altri legami. L’atomo accettore deve avere un orbitale vuoto nel suo livello di valenza e , accettando il doppietto elettronico, completa la sua configurazione elettronica esterna. Il legame dativo viene indicato con una freccia che va dall’atomo che dona all’atomo che accetta.
Esempio: l’ammoniaca ($NH_3$), che ha una coppia di elettroni non impegnata in nessun legame, può formare un legame dativo con lo ione idrogeno H+, che ha l’orbitale esterno 1s vuoto:

Un altro esempio di legame dativo è dato dall’acido nitrico: l’azoto crea un legame covalente con il primo atomo di ossigeno, che a sua volta lo crea con l’idrogeno, ed un doppio legame con il secondo atomo di ossigeno. A questo punto l’azoto possiede un doppietto elettronico solitario che dona ad il terzo atomo di ossigeno che si comporta da accettore:

Potrebbe interessarti anche
- Videolezione di chimica: I legami chimici
- La composizione della materia
- La teoria atomica di Dalton
- Gli isotopi
- Il modello atomico di Thompson e di Rutherford
- Il modello atomico di Bohr
- Il principio di indeterminazione di Heisenberg
- Gli orbitali
- Metodi di separazione
- Configurazione elettronica
- Tavola periodica degli elementi
- Gli isotopi
- La mole
- La legge di Gay-Lussac
- Formule chimiche
- Legami chimici [1]
- Legami chimici [2]
- Legami chimici [3] – Orbitali molecolari
- Legami chimici [5] – Legame ionico
- Legami chimici [6] – Legame metallico
L'articolo Legami chimici [4] – Legame covalente polare e dativo sembra essere il primo su Matematicamente.